1. Susunan
atom-atom
Logam merupakan struktur
raksasa dari atom-atom yang berikatan satu sama lain melalui ikatan logam.
“Raksasa” menunjukkan jumlah yang sangat banyak tetapi jumlah atom yang
terlibat sangat bervariasi – tergantung pada ukuran potongan logam.
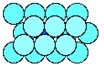
Koordinasi 12
Kebanyakan logan adalah terjejal
(close packed) – yakni, struktur tersebut memuat atom sebanyak mungkin
pada volum yang tersedia. Setiap atom pada struktur mengalami 12 sentuhan dari
atom tetangganya. Keadaan logam yang seperti ini digambarkan sebagai
terkoordinasi 12.
Tiap atom memiliki 6 sentuhan dari atom yang lain
pada tiap lapisan.
Dan juga tiga atom yang menyentuhnya pada lapisan
diatasnya dan tiga atom yang lain pada lapisan dibawahnya.
Diagram yang kedua tersebut
menunjukkan lapisan yang terletak di atas lapisan yang pertama. Lapisan
tersebut akan saling berhubungan dengan lapisan dibagian bawahnya. (Keduanya
tersusun dengan cara penempatan yang berbeda dengan lapisan yang ketiga pada
struktur terjejal, tetapi hal ini dipelajari pada pembahasan tingkat dasar)
Koordinasi 8
Beberapa logam (khususnya yang
terletak pada golongan 1 pada tabel periodik) terjejal kurang efektif,
atom-atom logam tersebut hanya memiliki 8 sentuhan atom tetangganya. Inilah
yang disebut dengan terkoordinasi 8.
Diagram sebelah kiri
menunjukkan bahwa tidak ada atom yang saling bersentuhan satu sama lain pada
satu lapisan yang sama. Atom-atom tersebut hanya tersentuh oleh atom pada
lapisan di atas dan dibawahnya. Diagram sebelah kanan menunjukkan 8 atom (4 di
atas dan 4 di bawah) yang menyentuh atom yang berwarna gelap).
Butiran kristal
Adalah sesuatu hal yang dapat
menyesatkan jika mengira bahwa semua atom pada sepotong logam tersusun pada
cara yang teratur. Tiap potong logam terdiri dari jumlah “butiran kristal”,
yang sangat banyak, yang mana tiap butiran memiliki daerah yang seragam. Pada
atom yang terletak pada batas butiran dapat memiliki struktur yang tidak lurus.
2. Sifat
fisik logam
Titik leleh dan titik didih
Logam-logam cenderung memiliki
titik leleh dan titik didih yang tinggi karena kekuatan ikatan logam. Kekuatan
ikatan berbeda antara logam yang satu dengan logam yang lain tergantung pada
jumlah elektron yang terdelokalisasi pada lautan elektron, dan pada susunan
atom-atomnya.
Logam-logam golongan 1 seperti
natrium dan kalium memiliki titik leleh dan titik didih yang relatif rendah
karena tiap atomnya hanya memiliki satu elektron untuk dikontribusikan pada
ikatan – tetapi ada hal lain yang menyababkan hal ini terjadi:
·
Unsur-unsur golongan 1 juga tersusun dengan
tidak efektif (terkoordinasi 8), karena itu tidak terbentuk ikatan yang banyak
seperti kebanyakan logam.
·
Unsur-unsur golongan 1 memiliki ukuran atom yang
rekatif besar (berarti bahwa inti jauh dari elektron yang terdelokalisasi) yang
juga menyebabkan lemahnya ikatan.
Daya hantar listrik
Logam menghantarkan listrik.
Elektron yang terdelokalisasi bebas bergerak di seluruh bagian struktur tiga
dimensi. Elektron-elektron tersebut dapat melintasi batas butiran kristal.
Meskipun susunan logam dapat terganggu pada batas butiran kristal, selama atom
saling bersentuhan satu sama lain, ikatan logam masih tetap ada.
Cairan logam juga
menghantarkan arus listrik, hal ini menunjukkan bahwa meskipun atom logam bebas
bergerak, elektron yang terdelokalisasi masih memiliki daya yang tersisa sampai
logam mendidih.
Daya hantar panas
Logam adalah konduktor panas
yang baik. Energi panas diteruskan oleh elektron sebagai akibat dari penambahan
energi kinetik (hal ini memnyebabkan elektron bergerak lebih cepat). Energi
panas ditransferkan melintasi logam yang diam melalui elektron yang bergerak.
Kekuatan dan kemampuan kerjaSifat dapat ditempa dan sifat dapat diregang
Logam digambarkan sebagai
sesuatu yang dapat ditempa (dapat dipipihkan menjadi bentuk
lembaran) dan dapat diregang (dapat ditarik menjadi kawat). Hal
ini karena kemampuan atom-atom logam untuk menggelimpang antara atom yang satu
dengan atom yang lain menjadi posisi yang baru tanpa memutuskan ikatan logam.
Jika tekanan yang kecil dikenakan
pada logam, lapisan atom akan mulai menggelimpang satu sama lain. Jika tekanan
tersebut dilepaskan lagi, atom-atom tersebut akan kembali pada posisi asalnya.
Pada kondisi seperti itu, logam dikatakan menjadi elastis.
Jika tekanan yang lebih besar dikenakan
pada logam, atom-atom akan menggelimpang satu sama lain sampai pada posisi yang
baru, dan logam berubah secara permanen.
Penggelimpangan lapisan atom
antara yang satu dengan yang lain ini dihalangi oleh batas butiran karena baris
atom tidak tersusun sebagai mana mestinya. Hal ini mengakibatkan semakin banyak
batas butiran (butiran-butiran kristal lebih kecil), menyebabkan logam lebih
keras.
Untuk mengimbangi hal ini,
karena batas butiran merupakan suatu daerah dimana atom-atom tidak berkaitan
dengan baik satu sama lain, logam cenderung retak pada batas butiran. Kenaikan
jumlah batas butiran tidak hanya membuat logam menjadi semakin kuat, tetapi
juga membuat logam menjadi rapuh.
Pengontrolan ukuran butiran kristal
Jika kamu memiliki bagian
logam yang murni, kamu dapat mengontrol ukuran butiran kristal melalui perlakuan
panas atau melalui pengerjaan logam.
Pemanasan logam cenderung
untuk mengocok atom-atom logam menjadi susunan yang lebih rapi – penurunan
jumlah batas butiran, dan juga membuat logam lebih lunak. Pembantingan logam
ketika logam tersebut mendingin cenderung untuk memhasilkan butirn yang kecil.
Pendinginan membuat logam menjadi keras. Untuk memperbaiki kinerja ini, kamu
dapat memanaskannya lagi.
Kamu juga dapat memutuskan
susunan yang atom teratur melalui penyisipan atom yang memiliki ukuran sedikit
berbeda pada struktur logam. Alloy seperti kuningan (campuran
tembaga dan seng) lebih keras dibandingkan logam asalnya karena
ketidakteraturan struktur membantu pencegahan barisan atom tergelincir satu
sama lain.






0 komentar:
Posting Komentar